以下内容转自“RNAScript”公众号
环状RNA(circRNA)是一类独特的共价闭环RNA分子,在调控生理和病理进程中,通过不同的机理发挥着重要作用。传统上,circRNA被认为是一种非编码RNA(ncRNA)。2014年,在北卡罗来纳大学任教的王泽峰教授和汪洋博士首次报导了环形RNA在细胞内可通过非帽依赖的机理来翻译蛋白,人们首次认识到circRNA也具有编码与表达蛋白的能力。此后,随着体外环化技术的发展,比线性mRNA稳定性更强的合成circRNA成为mRNA治疗领域备受关注的新技术,有望以mRNA药物相似的递送方法,实现疾病的治疗。
虽然目前circRNA疗法已成为RNA领域“顶流”,备受青睐,相关管线布局已有数十条,但我们对这个仍处于早期阶段的技术依旧充满了未知,其研发与生产也并不成熟。circRNA药物研发的两个主要障碍便是高效生产方法的开发和递送系统优化。
为了加速该领域的发展,近日,加拿大核酸疫苗与治疗研究主任(Canada Research Chair)、多伦多大学药学院助理教授李博文团队在Advanced Drug Delivery Reviews期刊发表了题为:Clinical delivery of circular RNA: Lessons learned from RNA drug development(环状RNA的临床转化:从RNA药物开发中吸取的经验教训)的综述文章。在本文中,作者概述了circRNA结构和功能的研究进展,合成circRNA的最新技术,重点介绍了关键的递送策略及其应用,并讨论了circRNA治疗领域当前的挑战与未来前景。
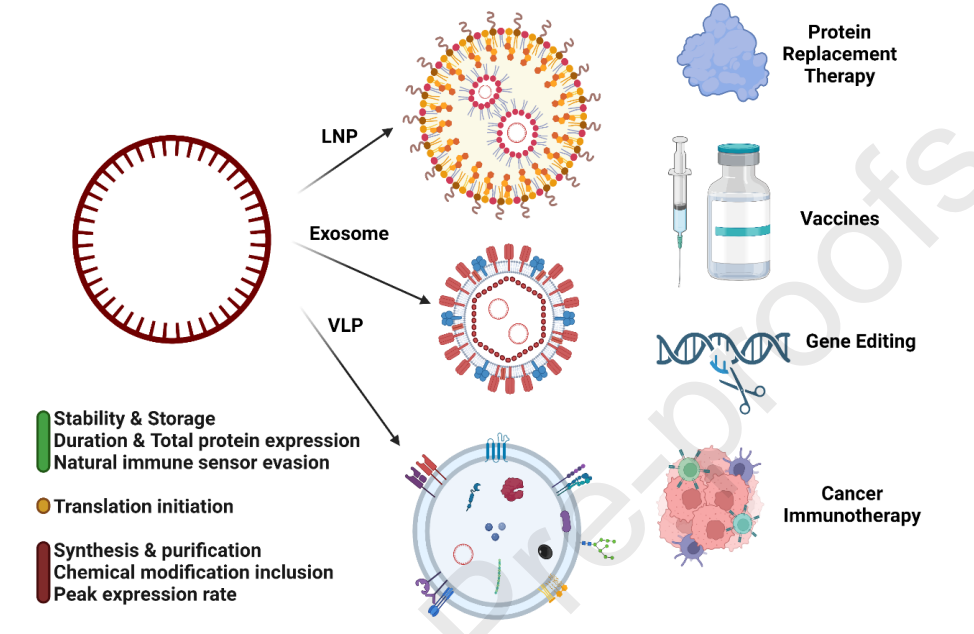
图1 图形摘要
circRNA的特点
(1)强稳定性:与线性RNA相比,circRNA的主要优势就是其环状结构提高了稳定性。因为circRNA中5’和3’末端的缺失使其具有外切酶抗性,不能通过典型的RNA降解途径降解,需要通过核酸内切酶线性化后将其降解(图2,a-c),因此,具有更高的体内稳定性,半衰期更长;
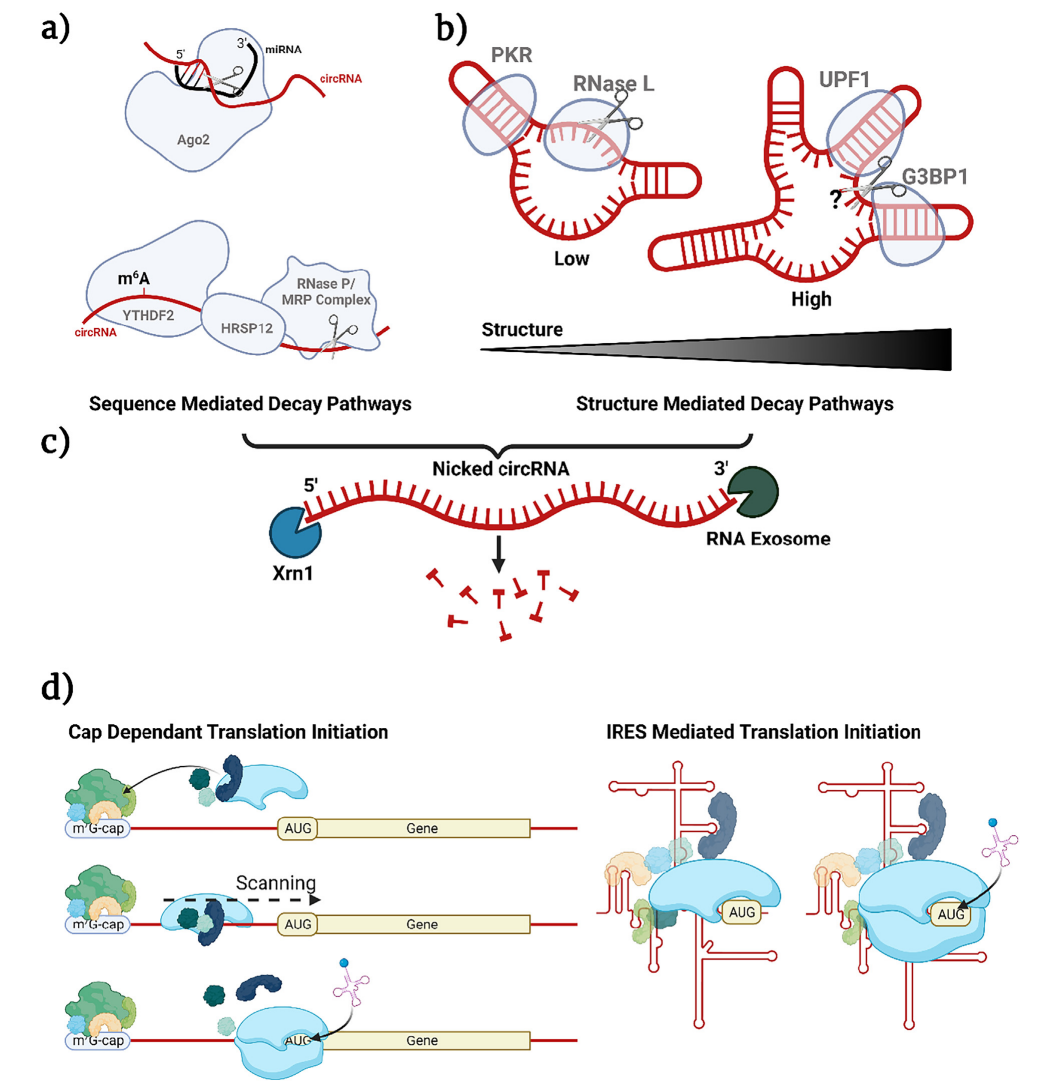
图2 circRNA的降解和翻译
(2)非帽依赖性翻译:大多数真核生物mRNA的翻译起始于5’端,以典型的帽(7GpppN)依赖方式进行(图2,d),由于步骤复杂且需要招募较多起始因子,该过程具有高能量消耗的特点,因此,当机体处于病毒感染或疾病等细胞应激的不利条件下,该典型翻译起始将被整体抑制,以确保细胞响应应激并存活。那么当典型翻译机制下调时,维持细胞生存所需要的关键蛋白的产生就需要另一套非典型翻译机制,即非帽依赖性翻译,例如通过内部核糖体进入位点(IRES)来驱动,而这种非帽机制正适合无5’端的circRNA,已知IRES是circRNA主要的翻译方式。
换言之,在疾病治疗过程中,当机体处于ER应激、遗传毒性应激、缺氧、营养剥夺、体温过低、体温过高或感染状态下,帽依赖性翻译起始被抑制,线性mRNA无法有效翻译,基于mRNA的药物疗效降低,而circRNA可凭借非帽依赖性翻译的机制优势,保证蛋白质的正常翻译,保证药物疗效。
(3)多顺反子表达:多顺反子表达是指从单个mRNA分子中翻译两个或多个独立的基因。对于多顺反子线性mRNA,5’cap比IRES的表达更高,导致蛋白表达比例不均。而对于circRNA,通过引入多个IRES-ORF,有可能达到接近化学计量的多顺反子表达,因为所有编码的蛋白质都具有相同的翻译起始机制。虽然这一点尚未得到证实,但circRNA的多顺反子表达可能有益于多组分蛋白质疗法,其中蛋白质复合物组分的受控比例至关重要。
(4)免疫原性低:线性RNA通过病原体识别受体(如RIG-I、TLR3、 TLR7、TLR8等)刺激先天免疫,导致干扰素反应,进而对其翻译及应用造成了负面影响;而纯的circRNA并不存在RIG-I、TLR3、 TLR7及TLR8的识别序列,这种“免疫沉默(immunosilent)”可以使其更有效地表达蛋白质,而没有抑制性干扰素反应。此外,先天免疫系统激活减少限制了树突状细胞的活化和成熟,有助于防止对编码的治疗蛋白产生免疫力。
治疗性circRNA的设计与合成
1
大小与结构对环化的影响
RNA环化的成功主要取决于前体circRNA(pre-circRNA)的长度、结构和浓度。随着长度的增加,分子内末端难以接触,而分子间末端更可能趋向于近距离;RNA结构的作用更为复杂,考虑到不同的环化缓冲液体系和温度,难以准确预测,甚至更难控制RNA结构;当RNA浓度增加时,由于分子间距离的缩短,分子间连接的可能性增加。因此,增加的长度、结构变化和高浓度都会降低前体circRNA 的自环化效率。
由于circRNA的应用集中在基因治疗、CAR-T细胞治疗、蛋白质替代疗法和疫苗,因此,提高表达效率的方法受到广泛关注。治疗应用的mRNA通常包含一个5'帽子,5'UTR,目的基因,3'UTR和一个聚A尾。虽然circRNA并不包含线性mRNA所必备的5'帽子、5'UTR、3'UTR、polyA尾等元件,但通过掺入合理设计的5′ UTR、3′UTR、间隔条和/或polyA,也可以显著改善其表达,不过潜在的机制目前鲜为人知。包含这些元素的潜在缺点是由于转录本长度增加而导致环化效率降低。
此外,由于circRNA的表达依赖于有效的IRES活性,很多团队都在持续筛选优化IRES或IRES样(IRES-like)元件。然而,有效的IRES往往很大,并且为保证IRES活性,对结构也有着严格的要求,不可被局部序列互补所破坏。间隔条(Spacers)是避免这种相互作用所必需的,其长度很小,仅略微增加转录本长度。常用的IRES,如脑心肌炎病毒(EMCV)或柯萨奇病毒B3(CVB3) IRES长约700 nt,虽然与目的蛋白质大小差异很大,但即使是表达最小的蛋白质,circRNA的最小长度也近1000 nt。考虑到人体中的平均蛋白质大小超过456个氨基酸(1368 nt)长,而用于基因治疗的传统Cas9核酸酶超过1000个氨基酸(>3000 nt)长,那么,为充分发挥circRNA的应用潜力,我们就必须具备高效合成数千 nt长circRNA的能力。
鉴于IRES长度与活性的限制,一些研究人员也在寻找可行的替代方案,如 m6A 修饰,它已被证明是人类circRNA蛋白质翻译的有效启动元件。考虑到已鉴定出大量RNA修饰,但很少有很好的表征,RNA修饰在治疗性circRNA翻译中发挥重要作用的潜力很大。
此外,已有研究发现,非帽依赖性翻译的启动效率存在明显的细胞和细胞状态的依赖性。虽然这对通用circRNA技术平台提出了挑战,但它也为细胞特异性表达的靶向设计提供了机会。
2
circRNA的环化策略
短链RNA可以通过化学连接法或酶法合成。化学连接法存在一个较严重的问题,由于磷酸迁移会形成2’-5’-磷酸键,而非天然的3'-5'磷酸二酯键,存在毒性等生物安全性问题。酶法合成可以通过使用DNA夹板链对自由端进行比对,然后添加DNA或RNA连接酶来帮助常规circRNA合成 (图3,a);也可以使用RNA二级结构来定向链末端代替DNA夹板链(图3,a)。
长链RNA的合成,业内主要使用PIE(permuted intron-exon)自催化剪接系统,该方法不适用于短链RNA是因为会保留辅助外显子序列,有可能会影响短链治疗性circRNA的功能。以PIE剪接系统做体外环化已有三十多年。2018年,Wesselhoeft与其合作者通过加入间隔物和同源区来限制不良结构相互作用并改善核酶作用,大大改进了该方法,以至于实现了长达1790 nt转录本的 95%的高效环化,合成了长达 5 kb 的 circRNA。该改造而来的体外环化技术又称I型内含子自剪接技术。
与I型内含子自剪接系统相比,使用II型内含子不需辅助外显子序列,即可产生预期的circRNA序列,不过,该方法的广泛适用性仍需更多研究验证。在国内,2022年中旬,中科院上海营养与健康研究所王泽峰研究团队曾在 bioRxiv 上刊出了其团队的最新成果,使用来自破伤风梭菌的II型内含子系统,自催化环化的效率约为70%[1]。
长链RNA的低成本大规模合成一直是业内备受关注的问题,合成超长链(>5000 nt)也依旧充满挑战。在此能取得突破的企业,曾获得令人印象深刻的估值和投资,即使尚处于管线的早研阶段,比如,Laronde和Orna Therapeutics各自获得了数亿美元的B轮融资。

图3.不同环化方法的比较(来源:耀海生物)
circRNA生产的核心挑战:纯化与质控
以PIE策略合成的circRNA,要清除所有具有免疫原性的化合物,往往需要多步纯化,如体积排阻色谱(SEC;通过HPLC)、circRNA富集(通过RNase R)和5′磷酸盐的去除(通过磷酸酶)。此外,circRNA中的病毒RNA序列(如PIE机制)也可能诱发免疫反应。去除具有免疫原性的杂质,对circRNA在基因治疗和蛋白替代疗法等应用中非常重要。
为了应对circRNA技术在医药领域的广泛应用,高效和高通量的纯化方法亟待建立。SEC可有效去除小切口的内含子(small excised introns ),并且根据孔径和RNA长度,可以显著去除前体RNA。然而,对circRNA产物与切口线性化的RNA片段(nicked circRNA)的分辨率通常很差,并且随着RNA长度的增加,分辨率会进一步受到影响。此外,SEC过程会稀释样品,必须浓缩以进行下游处理。至于替代方案,亲和层析法可以替代SEC或与SEC结合使用,通过选择性地捕获接头处的连接链(ligated strands),亲和层析法可以去除前体和内含子RNA,但不能去除nicked circRNA,同时保持较高的RNA洗脱浓度。
SEC无法完全去除RNA链意味着对RNase R的依赖性。在RNase R处理过程中,必须考虑完全线性RNA降解和circRNA自水解之间的平衡。RNase R缓冲液的组成、孵育温度,及有效去除线性RNA所需较长的处理时间,这会增加RNA自水解。例如,60分钟的反应时间会导致circRNA的急剧损失。实际上,自水解也阻碍了circRNA达到100%纯度,必要时,磷酸酶可能有助于掩盖病原体识别受体对线性RNA的识别。
此外,circRNA的纯化、表征与质控还存在其他一些挑战。比如,circRNA纯度的评估方法。为了评估circRNA产物与线性前体或切口circRNA的分离情况,常规进行RNAse R或RNase H处理,然后进行凝胶电泳,这个过程中,必须注意circRNA的自水解,因为它会使分析复杂化。在凝胶电泳中,两种物质之间的分辨率通常较差,circRNA与线性RNA的迁移速率可能取决于缓冲条件。EDTA等试剂可以改变迁移速率,但这可能是进行这些研究的E-Gel EX系统特有的。更复杂的是,circRNA的迁移速率可能出人意料地取决于运行时间,这可能是由于运行过程中的温度或不断变化的溶剂条件所导致的。因此,必须评估每个circRNA的理想运行时间和条件,变性剂有助于分离线性RNA与环状RNA。此外,线性和环状RNA之间迁移速率的相对差异随着转录本尺寸的增加而减小,这可能导致凝胶电泳中大链分辨率的实际限制(例如5000 nt或更大的转录本)。
circRNA的递送系统
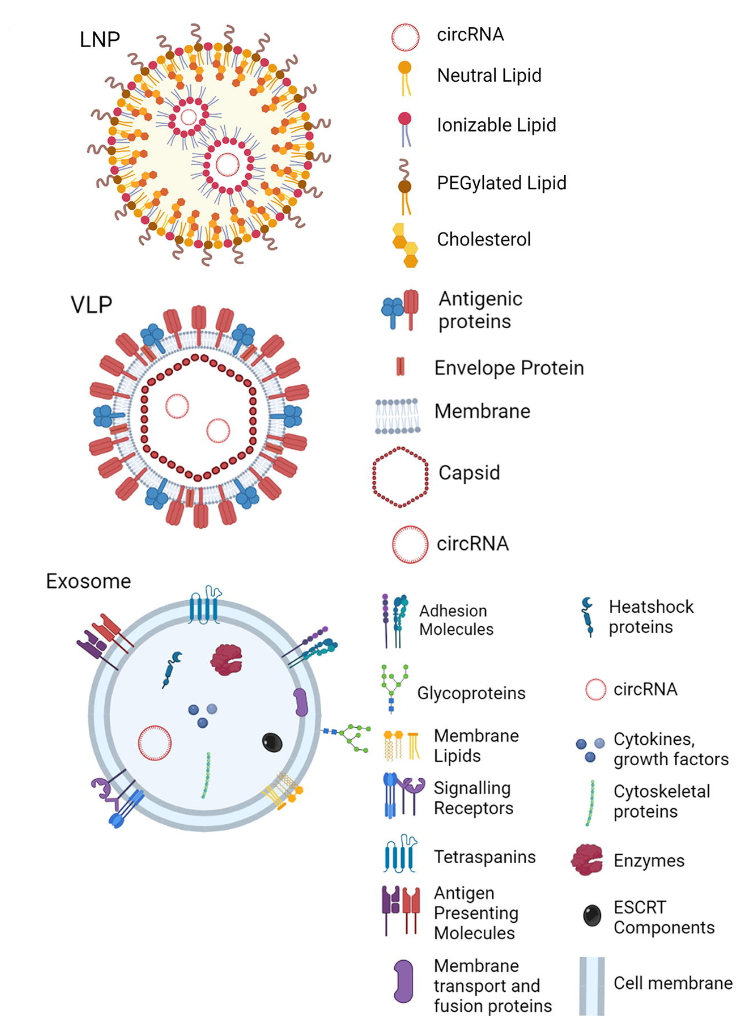
图4 circRNA的递送载体
1
LNPs
脂质纳米颗粒(LNPs)是现有新冠mRNA所使用的的递送系统。迄今为止,LNP已成功用于功能性RNA的递送,例如siRNA、mRNA,以及circRNA。在circRNA方面,头部企业Orna Therapeutics便采用了LNP系统。2022年,北大魏文胜团队研发的全球首个可对抗多种新冠变异株的circRNA疫苗,也同样采用了LNP系统[2]。
与其他递送载体相比,LNP具有诸多优势,已是目前最有效的和最常见的纳米递送载体。LNP成本较低,可以规模化生产,且可以在体内外进行经济快捷的高通量筛选,还可以通过改变LNP的性质,调整其稳定性、pKa及清除率,并可以直接对其进行质控。此外,采用微流控设备制备LNP时的包封率可以高达95%。
不过,LNP的一些缺点也不容忽视:LNP具有肝脏积累的倾向,肝外应用受限;LNP的内吞体逃逸率较低;同时,LNP必须经过修饰获取免疫原性。

图5 用于递送circRNA的外泌体、脂质纳米颗粒和病毒样颗粒特性的总结和比较
2
外泌体
外泌体是由大多数细胞分泌的小的细胞外囊泡(EV),它们含有其细胞来源的各种蛋白质、脂质和核酸。通常外泌体的直径为40-160nm,由脂质双层膜形成,其中包含各种脂质,以维持膜的刚性和流动性。外泌体会携带一系列内源性核酸,包括mRNA、miRNA,短和长ncRNA和circRNA,以及其他生长因子、细胞因子、ESCRT成分、热休克蛋白和细胞骨架蛋白。根据母细胞来源的不同,外泌体可以表现出不同的内在特性。
由于外泌体固有的生物相容性,低免疫原性,可以克服各种生物障碍, 在富含蛋白质、脂质和基因的不同细胞环境之间穿梭,因此是递送合成RNA的理想载体。鉴于已发现具有环状RNA的天然外泌体,所以circRNA与外泌体的相容性显而易见。
天然外泌体可以通过蔗糖梯度超离心、超离心、离心,以及ExoQuick等商业试剂盒从细胞中分离出来,且生物相容性更好,有些天然的外泌体可以穿过血脑屏障,靶向脑组织。但从生物液体中分离成本高且产量低,因此细胞来源外泌体和EV的使用有限。
人工外泌体可以通过挤压、过滤、微流体、超声、水泡,或用特定的蛋白质修饰脂质体的膜,以模拟细胞膜的组成和性质,从亲本细胞中制造获得。但目前的装载方式都尚不成熟,装载效率低。
此外,由于细胞来源的外泌体往往具有高度异质性,其内容和功能基于它们来源的亲本细胞,这一特性很难表征,分离后的纯化与修饰也具有挑战,缺乏可行和标准化的方法,也使得质量控制变得困难。同时,外泌体还需要特定的储存条件。这些属性都导致其大规模生产和临床应用,放大受限。
3
病毒样颗粒
病毒样颗粒(VLPs)是一种由类似于传染性病毒的病毒结构蛋白构建成的自组装的球形纳米载体,但不具备病毒复制相关核酸。根据重组蛋白表达的数量和类型的不同,会形成单层、双层或3层结构。VLPs已被成功应用于多款已上市疫苗,也被设计以装载与递送mRNA及核糖核蛋白。
VLPs是通过将编码病毒衣壳蛋白的基因克隆到原核或真核表达系统中而产生的,常见VLPs系统包括大肠杆菌、酵母菌、昆虫细胞、哺乳动物细胞和植物细胞,根据产生的病毒蛋白类型和任何必要的翻译后修饰来选择最佳表达系统,因为某些表达体系与产生的修饰(例如糖基化)不兼容。病毒结构蛋白表达并自组装后,分泌到表达细胞培养的培养基中。然后可以收集培养基,通过超离心、离心、PVDF过滤和/或亲和或离子交换层析来分离和纯化VLPs。
VLPs的表达系统成本较低,所以VLPs可以大规模低成本制备。VLPs具有高度的免疫原性,可诱导强烈的免疫反应。由于VLPs不包含病毒DNA,所以具有安全和高生物兼容性的优点。此外,VLPs通常稳定,也可通过化学和基因修饰增加其内在稳定性,适用于各种生产存储方式,如冻干或喷雾干燥。更重要的是,由于其病毒特性,VLPs在组织靶向递送方面非常高效,使其成为极有潜力的递送载体选择。
但是,VLPs也具有一些局限性。为优化VLPs的安全性及有效性,必须对其进行一系列下游处理,以控制其纯度和一致性,可能会包括耗时且多步的纯化过程,耗时又昂贵 。VLPs也可能对环境具有敏感性,对其稳定性和完整性造成影响,如温度、化学处理、剪切应力及搅拌。此外,由于VLPs的产生会非特异性包裹细胞内容物(如内源性蛋白及RNA),可能会对其疗效造成影响。
目前,已有多个研究证明了VLPs通过不同的负载方式及内/外部修饰的多样性,极大程度上提高了VLPs的递送能力。VLPs是一个具有前景的递送平台,可以用于circRNA的递送。
4
病毒载体
病毒载体用于circRNA的案例非常少。采用病毒载体递送circRNA时,需要DNA中间体进行体内的转录和环化,为了避免DNA整合风险,该递送方式在临床应用中具有明显的局限。不过,病毒载体递送还是可用于研究具有病毒嗜性的circRNA的功能和组织特异性调节。
circRNA的临床转化优势及其挑战
虽然COVID-19 mRNA疫苗的安全性和有效性证明了mRNA平台的实力,但mRNA的固有缺陷,限制了其在疫苗接种以外的治疗应用。与传染病疫苗相比,蛋白替代疗法等治疗应用往往需要mRNA达到50-1000倍的蛋白表达,因而需要进一步增强蛋白质翻译效率和mRNA稳定性,同时最大限度地减少免疫原性等不良影响。
circRNA的两大关键优势: (1)细胞内的稳定性更高;(2)未修饰时的免疫原性较低,可有力补足mRNA的不足,充分发挥RNA治疗的潜力。因此,circRNA治疗将有益于需要蛋白长期表达的疗法。
1
蛋白质替代疗法
蛋白质替代疗法的目的是恢复那些缺失或有缺陷的蛋白质功能,通常是由基因突变导致。采用mRNA治疗内源蛋白缺失已应用于多种疾病。
相对于mRNA,circRNA在蛋白替代疗法的应用中具有诸多优势,如结构具有更高的稳定性,蛋白质表达时间更长;具有与线性RNA相似的蛋白表达峰值,但下降率较低。这些优势使得circRNA可以产生较高的蛋白质累积并持续较长时间;减少给药频率,且免疫原性较低。
不过,circRNA也存在一些与mRNA相似的问题。如递送载体的选择,如果使用LNP,将同样具有肝脏积累的缺点,该问题的解决还需等待脂质纳米颗粒等递送载体的进一步开发与优化。
再如无法精准调控mRNA与circRNA的表达水平,使其维持在适当的功能水平,而不会过量表达导致毒性。虽然内源性基因表达有精准的调控和负反馈机制,但外源性合成RNA目前仅发现极少数分子调控机制参与调控。因此,目前基于mRNA与circRNA的蛋白质替代疗法仅限于具有宽治疗窗的疾病亚群,只有在这种条件下,才可避免过量的蛋白表达导致毒性的可能。
此外,虽然circRNA与mRNA相比免疫原性较低,但它仍然可以激活先天免疫系统。mRNA修饰已被证明可成功降低mRNA的免疫原性,然而,PIE自剪接系统与RNA修饰不相容,用N1-甲基假尿苷完全替代尿苷将导致环化失败。曾有研究发现,环化时纳入5% m6A将促进环化并降低免疫原性。总之,为进一步降低 circRNA的免疫原性,还需对 circRNA 修饰进行更深入的研究。
2
疫苗
mRNA疫苗具有高效、研发周期短、模块化生产、低成本等优势,已是最通用的疫苗种类,尤其在应对新冠等突发流行病,其极快的研发制造能力,优势极为显著。同时,在面对病毒变异方面,多价mRNA疫苗的易得性可及时提供针对多种病原体的保护,意义重大。
另外,mRNA疫苗的自佐剂效应也为疫苗保护性免疫的诱导提供了支持。在机制上,mRNA会引起与病毒免疫相关的Th1偏向免疫应答,诱导对T细胞扩增和免疫记忆形成至关重要的I型干扰素反应,对病毒预防极有帮助。不过该机制同时也限制了mRNA的帽依赖性翻译起始,影响表达效率。那么circRNA所使用的非帽依赖性起始机制,例如不受干扰素抑制的IRES,是一种有吸引力的替代方案。在保持circRNA抗原表达稳定的同时,更有效地诱导干扰素反应,可能会进一步增强疫苗的保护作用。
疫苗接种的目标是诱导强烈的适应性免疫反应和长期免疫记忆。适应性免疫记忆的诱导部分取决于抗原暴露的持续时间。因此,RNA编码抗原的长期表达可以更有效地引发具有持久免疫记忆的免疫反应 。与mRNA相比,circRNA固有的稳定性延长了蛋白质翻译的时间,增加了体内的蛋白质产量,长期表达抗原可以更有效地诱导具有持久免疫记忆的免疫反应。
与mRNA疫苗一样,递送也是环状RNA疫苗的主要挑战。临床上主要应用的递送载体LNP,含有聚乙二醇(PEG),可引发部分患者的过敏反应,开发不含免疫原性的递送载体将有利于mRNA和circRNA疫苗的安全性。同时,大多数呼吸道病毒通过黏膜途径进入人体,因此,开发可用于黏膜接种的新型递送载体,研发可以产生强大黏膜和全身免疫力的黏膜疫苗,将为呼吸道病原体的预防建立第一道防线。
3
癌症免疫疗法
癌症免疫治疗采用机体免疫的作用成分如细胞因子、抗体和免疫细胞等进行癌症的治疗。基于RNA的免疫治疗可以通过将癌症新抗原编码为疫苗、免疫刺激细胞因子、抗体和免疫细胞受体实现,具有灵活性及多功能性。此外,还可以通过非病毒载体以mRNA直接转染T细胞,在体原位生产CAR-T细胞,避免了传统CAR-T细胞制造的缺点。
circRNA在癌症免疫治疗中有几个优势:
(1)与mRNA相同,circRNA既可应用于肿瘤个性化治疗,也可同时编码多种新抗原,降低癌症逃逸和复发风险。对于精准细胞治疗,可以通过改变编码序列轻松定制嵌合抗原受体的circRNA编码,并定制以靶向不同类型的癌症进行精准癌症免疫治疗。
(2)circRNA的稳定性强,可以保证抗原蛋白的稳定表达;circRNA癌症疫苗可以延长抗原呈递,获得更强的免疫反应;增加免疫刺激蛋白,如细胞因子和小抗体片段的表达时间,可以更好地将免疫细胞招募到肿瘤部位;
(3)早期研究表明,修饰mRNA的低免疫原性对肿瘤中的蛋白质表达很重要,因此circRNA固有的较低免疫原性对于肿瘤内免疫刺激蛋白表达更具优势。未修饰的RNA激活先天免疫系统将降低抗体表达,阻止适应性免疫细胞有效募集到肿瘤中。
(4)由于IRES启动的非帽依赖性翻译既可适应各种复杂的肿瘤环境,也可抵抗癌细胞减缓蛋白翻译并逃逸细胞因子或抗体免疫治疗机制,增加了不同癌症治疗的一致性。
如前所述,circRNA在癌症免疫治疗中也具有一些亟待解决的问题。
(1)递送。一方面是肿瘤细胞的精准靶向递送,为了最大限度地减少对健康组织的损害,有效的circRNA癌症免疫治疗必须高度精确地靶向癌细胞;另一方面,免疫细胞,如T细胞,可能难以通过非病毒递送载体转染。病毒载体是最有效的,但在整合诱变和免疫原性方面具有更多风险。目前用于CAR-T疗法的非病毒递送载体只能转染17.5%-24.7%的T细胞。开发更好的非病毒载体可能有助于提高原位T细胞的转染效率。
(2)表达水平无法精准调控,使得癌症免疫疗法存在潜在危险,因为免疫刺激细胞因子或抗体的过度表达可能是有毒的。
4
基因编辑
在基因编辑方面,基于circRNA的稳定性,首先可应用于小的RNA组分,比如向导RNA(adRNA/gRNA),因为在基因编辑系统中的向导RNA是最脆弱的,很容易被核酸酶降解;其次,circRNA也有望用于编码基于蛋白质的编辑器以进行基因编辑。与mRNA相比,circRNA提供的稳定性和稳健表达可以使Cas9蛋白的持久性更长,增加的蛋白表达可能会显著提高基因编辑效率。
在ADARs介导的RNA编辑中,2019年,北京大学魏文胜课题组曾研发出了借助gRNA募集ADAR实现RNA精准编辑的新策略[3]:LEAPER™。LEAPER™通过在细胞中表达短工程化的ADAR募集RNA(ADAR-recruiting RNA,arRNA)来完成ADAR的招募以及RNA编辑,由于这种技术彼时尚不成熟, 具有一定长度的arRNA可能引起邻近的碱基的脱靶编辑。2022年,魏文胜课题组推出了LEAPER™的升级版本—— LEAPER™ 2.0,设计并运用了可招募ADAR的环形RNA(circular ARAR-recruiting RNA,circ-arRNA)[4],通过AAV递送,遗传编码的circ-arRNA可以在人的原代细胞和类器官中实现长时程的RNA编辑,这种可避免核酸外切酶切割的环状RNA进一步提升了体外和体内编辑的效率和精准性, 基本清除了双链RNA区域内目标转录本上的脱靶。
circRNA在基因编辑方面也面临着诸多挑战。
(1)在疫苗或免疫治疗中,RNA自身的免疫原性是耐受或者有益的,而在基因编辑中,则需要完全无免疫原性的RNA。因为RNA触发的免疫反应会干扰蛋白的表达并导致所编辑的细胞被清除。因此,应用于基因编辑的circRNA的免疫原性仍需进一步优化;
(2)基因编辑疗法对递送靶向性具有更高的要求,因此仍需探索有效的靶向递送工具;
(3)基因编辑疗法,特别是CRISPR-Cas9衍生的编辑技术,可能会在不需要的位置出现高频脱靶编辑。这些脱靶编辑增加了基因编辑疗法破坏基因功能并可能导致癌症的危险。限制编辑蛋白表达的持续时间是降低脱靶率的可行策略。不幸的是,circRNA延长了蛋白表达时间,可能导致脱靶效应增加。目前尚未有相关研究报道mRNA与circRNA所表达Cas9的脱靶效率差异,因此,需要进一步的研究来确定哪种基因编辑方法可以从circRNA增加的蛋白表达中受益;
(4)许多基于Cas9的基因编辑器蛋白很大,Cas9大小已达为4kb。然而,目前的生产方法尚且难以攻克大于5kb的circRNA的合成,这带来了极大的合成挑战。
5
非编码环状RNA治疗
circRNA在细胞内具有内源性非编码功能,如miRNA和RNA结合蛋白海绵功能。circRNA作为调控RNA,具有作为miRNA和RNA结合蛋白的竞争性抑制剂从而进行治疗的潜力。不过目前已有研究都处于体外实验阶段,尚未有体内数据,不过受限于递送问题,体内模型可能也难以实现。
结论及未来展望
circRNA是共价封闭的、高度稳定的RNA形式,具有巨大的治疗应用潜力。与线性蛋白相比,circRNA具有稳定性和蛋白质表达增强的能力等优点,在疫苗开发、癌症免疫治疗、蛋白质替代治疗和基因编辑方面有着广阔的可应用空间。
当然,作为一类新兴技术,也有诸多待攻克的难题:
1)合成挑战。尽管已经开发了用于环化的合成方法,但它们的效率会受到基因序列(由于结构相互作用)和长度的影响,从而导致产量低下;
2)纯化挑战,需要多种纯化方法才能有效分离产物;
3)递送挑战,虽然LNP等递送载体易广泛应用,但仍需要更多的研究来优化这些载体,以便将circRNA高效、靶向地递送到特定的细胞或组织;
4)由于circRNA是一类新的RNA疗法,因此,它们的药代动力学和在体内的生物分布有待更多研究。这使得预测最有效的剂量和给药方案变得具有挑战性;
5)免疫反应挑战,虽然未修饰的circRNA被认为比未修饰的线性RNA免疫原性低,但目前尚不清楚circRNA必须有多纯才能获得最佳治疗效果。
展望未来,circRNA领域的未来研究将侧重于改进线性RNA的有效环化和合成circRNA的纯化方法,优化circRNA靶向递送,进一步表征circRNA的体内分布、药代动力学和免疫反应,以及探索circRNA的新应用,以进一步提高我们对circRNA治疗效力的理解。
最终,circRNA在基于RNA的药物领域是一种有潜力的RNA形式,有望颠覆个性化治疗手段。