以下内容转自“RNAScript”公众号
可电离脂质纳米颗粒(LNP)在mRNA药物的临床应用中得到了广泛使用,药物的临床应用中得到了广泛验证,特别是在SARS-CoV-2 mRNA疫苗开发中大放异彩。由于mRNA疗法所具有的多功能性,使其在后疫情时代的应用潜力不断被发掘,肿瘤免疫疗法、蛋白质替代疗法、细胞工程及基因编辑等重要领域越来越多的采用到mRNA技术。不过,在这些不同组织、不同机制的多样化应用场景之下,mRNA药物面对的第一道难关便是对其递送系统的挑战。如何增加递送效率、提高组织靶向性、保证递送安全性,无一不在对递送系统的开发和优化提出更高的挑战。
当然,目前已有诸多研究性论文提供了一些关于如何合理设计可电离脂质以提高LNP递送mRNA性能的见解,但这些方法通常只涵盖了有限的结构空间,可能忽视了一些有前途的脂质设计。并且,传统的LNP开发过程,劳动密集、成本高昂且效率低下,严重依赖于试错。即使是莫德纳公司,10多年的开发中也仅仅验证了2000多种脂质。
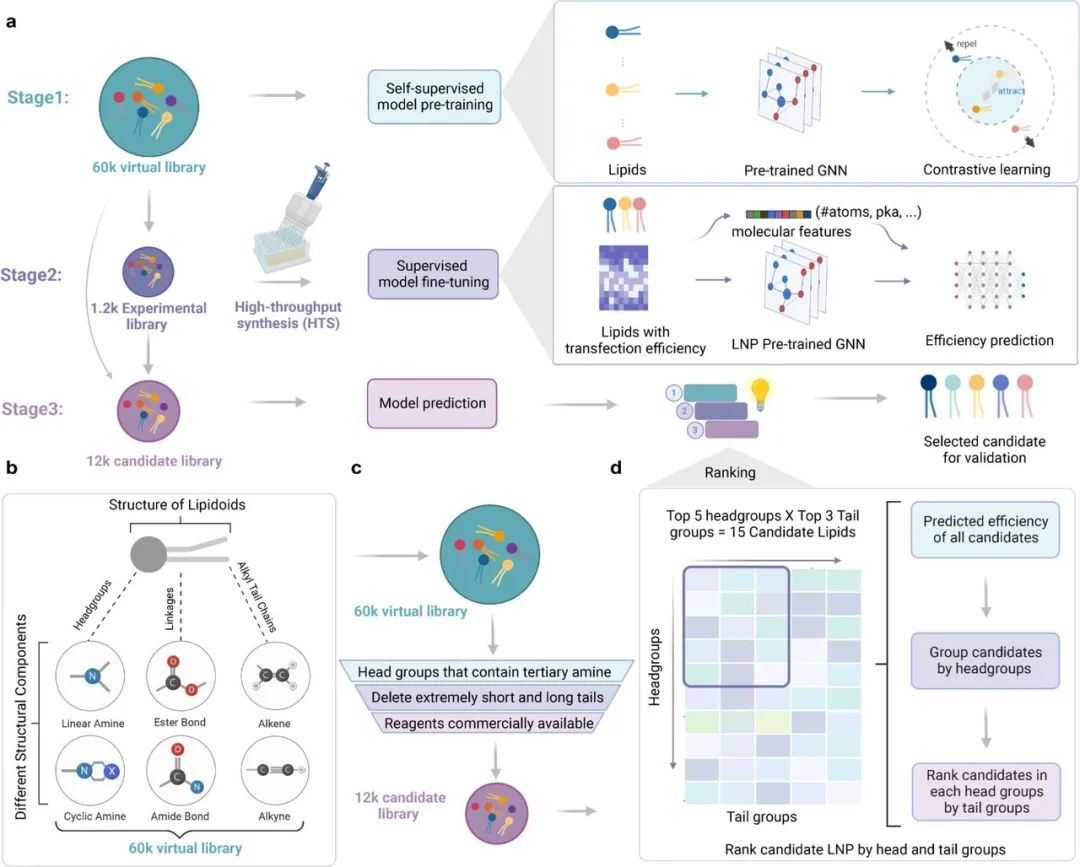
基于此,为了更高效、更有针对性地加速LNP的发现与优化,加拿大核酸疫苗与治疗研究主任(Canada Research Chair),多伦多大学药学院助理教授李博文团队与加拿大Vector 人工智能研究院(Victor Institute for AI)合作开发了AI-Guided Ionizable Lipid Engineering(AGILE)平台,首次利用深度学习和组合化学的协同来探索可离子化脂质分子搜索空间。相关论文近日已于bioRxiv上公开 ,题目为“AGILE Platform: A Deep Learning-Powered Approach to Accelerate LNP Development for mRNA Delivery”[1]。
AGILE平台通过预训练的深度学习神经网络学习大量小分子化合物的结构知识,并利用自我监督的方法学习对脂质结构的辨别和区分。经过微调和高通量筛选,AGILE能够准确识别具有较高mRNA转染效力的新型脂质结构。
简单而言,AGILE简化了可电离脂质的迭代开发,并具有三个重要优势:
1)高效设计和合成组合脂质库,使用深度神经网络进行全面的计算机辅助脂质筛选,以适应多种细胞系。
2)使用AGILE,研究者能够从超过10,000个候选者中快速选择、合成和评估适用于肌肉和免疫细胞中mRNA递送的新型可电离脂质结构。
3)AGILE揭示了细胞特异性的可电离脂质偏好,表明需要不同的尾长和头基团以实现对不同细胞类型的最佳递送。
该研究首次证明AI深度学习在加速和定制化LNP开发方面的潜力,通过把AI与组合化学的优势相结合,AGILE平台可灵活有效地解决临床实践中mRNA递送的复杂需求,从而扩大mRNA疗法的范围和效果,并有望大幅增速核酸药物商业化落地。
AGILE平台
最近,利用多组分反应的组合化学已经被用来实现脂质库的高通量合成。例如,李博文团队曾发表的一个基于Michael加成的的多组分反应系统,被用来生成超过700个可电离脂质的库[2],从而发现了一种特别适合于有效递送mRNA到肺上皮细胞的靶向性脂质。虽然多组分反应的组合化学已经被展示出可以促进新的可电离脂质的合成,但构建和测试一个结构更广泛且数量庞大的脂质库,可能需要数十万种化合物。检验这些化合物在不同的细胞目标中的mRNA转染仍然是一个艰巨、耗时且昂贵的任务。这个挑战因此限制了设计和测试更多样化和创新结构的努力。因此需要新的策略来加快发现和优化可电离脂质,以实现在特定目标细胞中的mRNA理想转染。
推荐阅读:李博文等开发新型LNP载体,吸入后可实现对肺部的高效mRNA递送及基因编辑
本研究通过将深度学习方法与基于组合化学的脂质合成相结合,创造了一个名为AGILE的平台,旨在加速新型可电离脂质的发现。AGILE平台包含一个深度学习算法模型,可以有效地捕捉可电离脂质分子结构的内在特性和化学属性,其实施过程主要通过三个关键阶段:
1)创建虚拟库并进行自我监督模型训练:利用实验库获取实验证据数据,通过有监督的微调提高预训练模型的准确性。采用优化的深度学习算法对候选库中的可电离脂质进行硅谷分析。AGILE平台能够预测可电离脂质在LNP配方中对mRNA的转染能力,并方便特定靶细胞的LNP设计。